15 novembre 2021 - Immunothérapies passives dans l’infection par le SARS-CoV-2*
Ioanna Christodoulou1, Jacques H.M. Cohen2
1 Institut Lavoisier de Versailles, UMR CNRS 8180, Université Paris-Saclay, Université de Versailles St-Quentin-en-Yvelines 78035 Versailles cedex, France
2LRN EA4682 URCA Reims, Pôle Santé, 5 rue Cognacq-Jay, 51100 Reims, France
Correspondance : J.H.M. Cohen
⇐ Retour au dossier "Actualités COVID-19"
* Cet article est une note de situation et non une revue générale dont l’exhaustivité serait impossible dans un contexte aussi mouvant. La FDA (Food and Drug Administration) des États-Unis annonce 60 projets d’anticorps monoclonaux thérapeutiques en évaluation continue (rolling out examination) ! À l’inverse, la sélection présentée peut paraître arbitraire, évaluant peut-être à tort les chances de succès rapide de tel ou tel projet.
Introduction
Devant une nouvelle maladie infectieuse envers laquelle on est démuni, le réflexe est immédiat d’envisager une sérothérapie ou séroprévention à partir du sérum de convalescent. Dans l’histoire de l’immunologie, c’est von Behring et Kitasato qui les premiers ont réalisé cela pour la diphtérie en 1890 (figure 1) [1-3]. D’autres séroprophylaxies ont été rapidement mises au point, par exemple contre le tétanos avec un certain succès, mais il fut vite constaté que la sérothérapie n’était pas efficace pour toutes les maladies infectieuses [4]. Cela reste vrai, non seulement aux conditions de l’époque, mais à celles d’aujourd’hui, par exemple pour l’Ebola [5]. Néanmoins, des premières tentatives furent rapidement pratiquées, y compris en France, de préparer des gammaglobulines à partir de sujets convalescents du Covid-19 (coronavirus infectious disease caused by SARS-CoV-2) [6].

Figure 1: Réduction des cas de diphtérie à Paris après introduction de la sérothérapie antidiphtérique en 1894 [3].
A. Reproduction de la courbe du nombre de cas de diphtérie à Paris, entre 1890 et 1897. La ligne horizontale partant de 100 représente la mortalité moyenne par diphtérie pour les années 1890 à 1893. Le nombre de cas est donné par quinzaine. La partie de gauche représente les oscillations de la mortalité moyenne par diphtérie en 1894 ; la moitié droite représente les oscillations moyennes pour 1895-1897. B. Reproduction du tableau indiquant la mortalité annuelle par diphtérie, de 1865 à 1896, à Paris.
Dès le début de l’épidémie de Covid-19, les difficultés des sérothérapies en matière de mauvaise reproductibilité de lots mal définis en termes d’activité anticorps et neutralisante, étant connues, de nombreuses tentatives se sont immédiatement portées vers la réalisation d’anticorps monoclonaux dont la cible peut être parfaitement définie et la production parfaitement contrôlée [7].
Les différents produits utilisés
Sérum de convalescents
Les premières tentatives d’administration de pools de sérum de convalescent, puis de fraction IgG purifiée chez des patients atteints de Covid-19 grave ont été des échecs totaux. Des tentatives d’administration précoce dans la maladie ont amené des succès modestes mais réels, et les difficultés pratiques d’obtention de gammaglobulines spécifiques en forte quantité ont partout fait renoncer à tenter d’évaluer leur usage prophylactique [8, 9]. Les raisons de l’échec pratique des sérothérapies restent peu élucidées : quantité d’anticorps insuffisante ? Perturbation de la réponse anticorps dans sa régulation idiotypique ? Exacerbation paradoxale (Antibody Dependant Enhancement, ADE) méconnue liée à une partie des anticorps administrés [10, 11] ?
Anticorps monoclonaux
Deux grandes catégories d’anticorps monoclonaux ont été développées. D’une part, des anticorps monoclonaux à potentiel immunomodulateur, d’autre part des anticorps monoclonaux dirigés directement contre le virus et tentant d’empêcher le plus souvent sa pénétration dans les cellules. Concernant les immunomodulateurs, la liste est très longue des anticorps monoclonaux immunosuppresseurs testés comme des perturbateurs ou bloquants de telle ou telle étape de la réponse immune. Rien que sur le système de complément, il a été testé de bloquer l’activité du C1Q, celle de la C1 estérase, celle du C2, du C3 et de certains de ses récepteurs, celle du C5 et de ses récepteurs. C’est surtout cette dernière cible qui a paru déterminer des résultats encourageants, quoique non décisifs [12-14]. Mais c’est une autre cible qui s’est avérée la plus digne d’intérêt : le blocage de l’IL6 ou de ses récepteurs qui a reçu une approbation comme thérapeutique dans les formes graves ou susceptibles de le devenir. L’efficacité de cette thérapeutique est cependant relative [15-17].
Les anticorps monoclonaux dirigés contre le virus lui-même
D’où viennent-ils ?
Toutes les technologies de développement d’anticorps monoclonaux ont été utilisées, des hybridomes souris façon Köhler et Milstein [18] jusqu’à l’immunisation d’autruches pour la récupération d’anticorps dans leurs œufs, afin de réaliser une séroprophylaxie muqueuse directe intranasale, mais sans doute aussi pour récupérer le répertoire d’un volatile avec la perspective de dénicher des anticorps très différents de ceux des mammifères. Si l’on retient ceux qui ont été utilisés pour fabriquer des anticorps aboutissant à un traitement chez l’homme, on peut constater que la méthode classique d’hybridome a eu des succès qui, bien sûr de nos jours, ont été complétés par la récupération de cet anticorps et son insertion dans une charpente d’immunoglobuline humaine aboutissant à des traitements par anticorps humanisé. Des hybridomes humains ou des immortalisations, par
exemple l’EBV, ont été réalisés aboutissant à des productions clonales à partir d’une seule cellule du répertoire d’un individu. On s’est également passé de tout développement cellulaire, par des techniques de récupération du répertoire au stade des acides nucléiques et de criblages par affichage sur phage (phage display) [22]. Les anticorps humains ont été produits à partir de sujets convalescents à une notable exception de la récupération d’un clone à très large cross-réactivité couvrant tous les variants du SARS-CoV-2 à partir d’un sujet qui avait été infecté en 2003 par le SARS-CoV-1 [21, 22]. Les charpentes utilisées pour humaniser des anticorps de souris ont été des charpentes IgG1, dans certains cas avec des modifications ponctuelles améliorant la durée de vie, les propriétés du Fc (Fragment crystallizable region) ou la bio distribution [19]. .
Où s’attachent-ils ?
Si le concept d’anticorps anti-Spike vise à bloquer l’entrée du virus dans la cellule en empêchant son attachement sur son récepteur, il faut remarquer que les sites de liaison des anticorps neutralisants ne sont pas exclusivement ceux de l’interaction entre le Spike et le récepteur ACE2 [23, 24]. Les sites de liaisons des anticorps sur le Spike aboutissant en thérapeutique humaine se répartissent dans deux régions du Spike au minimum permettant ainsi la liaison simultanée d’au moins deux anticorps non compétitifs entre eux (figure 2). Si les sites de liaisons exacts de certains anticorps monoclonaux ont été publiés [25], ce n’est pas le cas général, et il n’a pas été possible, faute de disposer des dossiers soumis aux différentes agences, de reconstituer une cartographie détaillée par anticorps au-delà d’indiquer que ce sont les régions NTD (N terminal domain) et RBD (Receptor Binding Site) qui sont concernées par la plupart des anticorps neutralisant l’infection. Une telle cartographie serait pourtant importante, car cette largeur de protection des produits de telle ou telle firme vis-à-vis de tel variant existant ou à venir a de forte chance de pouvoir être prise en défaut. Il serait souhaitable de savoir si les produits de la firme A et de la firme B ont une chance d’être synergiques ou si la chose peut être exclue par le simple regard de la proximité ou de l’identité des épitopes reconnus.
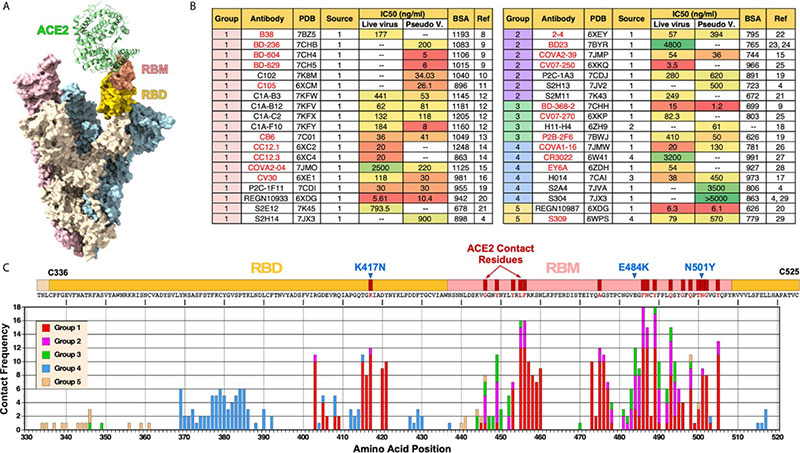
Figure 2. [23] A. Structure cryo-EM de la glycoprotéine trimérique de la spicule (Spike) (PDB : 7A97). L’un des monomères (beige) avec ACE2 lié à son RBD (Receptor Binding Domain) et RBM (receptor binding motif) colorés en or et saumon, respectivement. B. Les anticorps sont organisés par regroupements. C. Fréquence des anticorps faisant contact avec chaque acide aminé dans le RBD. Chaque groupe est représenté par des couleurs différentes. Trois mutations RBD présentes dans le variant B.1.351 du SARS-CoV-2 (K417N, E484K et N501Y) sont représentées.
Plusieurs grandes firmes, dont les produits arrivent au stade d’utilisation, ont fait le choix d’associer deux anticorps : c’est le cas de Roche/Regeneron [26], d’Eli Lilly [27], et d’AstraZeneca [28]. GSK utilise un seul anticorps à réactivité présentée comme ultra-large, et présumé ne pouvant être pris en défaut puisqu’il est également actif sur le SARS-CoV-1 [20].
Inconvénients et risques de l’utilisation thérapeutique ou préventive d’anticorps monoclonaux
Le principal risque est bien sûr la pression de sélection offrant un avantage compétitif aux variants échappant à leur action. Même si les paires d’anticorps sont supposées insensibles ou moins sensibles à cet échappement. L’anticorps de GSK sotrovimab, originaire d’un patient atteint de SARS-CoV-1 est le moins sensible à ce risque, car il reconnaît un épitope largement conservé parmi tous les SARS-CoV [29].
L’exacerbation paradoxale de la Covid-19 (ADE) n’a pas été constatée en modèles animaux [30]. Elle ne s’est pas produite dans les tests cliniques prophylactiques. Même si elle ne peut pas être exclue dans l’éventualité de variants à échappement partiel [23, 24], elle semble très peu probable ici, contrairement à des exemples animaux aggravés par la vaccination ou le transfert passif, chez le poulet par exemple [31].
Cette situation heureuse et en fait inhabituelle parmi les infections à coronavirus, mérite d’être surveillée lors de l’apparition de nouveaux variants, non seulement pour l’usage d’anticorps prophylactiques, mais pour celui de vaccins sub-unitaires ou de Spikes modifiés en conséquence si les choses évoluaient défavorablement.La fabrication est lourde et la production à large échelle est coûteuse.
Indications
La plupart de ces anticorps n’ayant peu ou pas d’actions dans les formes évoluées de Covid-19, c’est leur utilisation précoce ou préventive qui est envisagée. Ce n’est pas seulement parce que ces produits sont lourds à produire que leur indication va concerner une population restreinte, c'est aussi pour ne pas généraliser la pression de sélection de variants qu’ils pourraient induire. En effet, in vitro, la culture du virus en présence de sérum convalescent polyclonal est un moyen efficace de sélection faisant varier considérablement une souche, jusqu’à l’échelle des variants naturels connus en moins de trois mois de culture [32]. L’indication retenue est donc la séroprophylaxie chez les sujets en échec de vaccination ou chez qui on peut prédire cet échec. En particulier certaines chimiothérapies, et traitements immunosuppresseurs. Notamment les traitements visant directement la réduction des lymphocytes B comme le rituximab [33]. Certaines affections génétiques à risque accru de gravité du Covid-19 comme la trisomie 21, les transplantés rénaux, et plus généralement, les dialysés rénaux constituent l’essentiel de cette population que l’on peut estimer en France autour de 500 000 personnes mais probablement en dessous du million.
Au 18 octobre 2021, si l’Union européenne a déjà validé et commandé plusieurs produits (tableau 1), seul le produit de Roche/Regeneron est distribué en France. Il ne semble pas qu’il soit administré pour l’instant à tous les patients qui le justifieraient, probablement pour des questions de stocks disponibles. En fait, la disponibilité des produits des autres marques serait également souhaitable afin de pouvoir adapter les choix ou associer les produits si l’épidémie se poursuivait avec de nouveaux variants.
Tableau 1. Anticorps monoclonaux antivirus disponibles comme médicament aux États-Unis ou en Europe.
|
Laboratoires |
Nom |
Type |
Origine |
ATUc |
|
Roche/Regeneron [34] |
RONAPREVE/ REGN-COV2 Casirivimab + imdevimab |
REGN10933 + REGN10987 |
Souris humaine |
Europe/USA |
|
Eli Lilly [35, 36] |
Etesevimab + bamlanivimab |
JS016, LYCoV016, LY3832479, CB6-LALA ; combination with LY-CoV555/LY3819253 |
Cellule B humaine |
Europe/USA |
|
AstraZeneca [28] |
AZD7442 |
AZD8895 + AZD1061 |
Cellule B humaine |
Europe |
|
GSK [29, 37, 38] |
Sotrovimab |
VIR-7831, GSK4182136 |
Cellule B humaine (SARS-COV) 2003 |
Europe/USA |
|
Celltrion [19, 39] |
REGKIRONA Regdanvimab |
CT- P59 |
Banque de phage |
Corée/Europe |
Le développement de nombreux essais thérapeutiques est recensé dans le tableau 2. Et une tentative d’un récapitulatif plus exhaustif figure en matériel supplémentaire en ligne (tableur général des anticorps thérapeutiques en essais cliniques , doi : 10.1684/vir.2021.0922).
Tableau 2. Principaux anticorps monoclonaux immunomodulateurs utilisés dans la Covid-19.
|
Laboratoires |
Nom |
Cible |
Références |
|
Janssen |
Sirukumab |
IL-6 |
|
|
CSL Behring (formerly Vitaeris Bio) |
Clazakizumab |
IL-6 |
|
|
R-Pharm JSC, Cromos Pharma |
Olokizumab |
IL-6 |
|
|
EUSA Pharma, University Hospital, Ghent, A.O. Ospedale Papa Giovanni XXIII |
Siltuximab |
IL-6 |
|
|
Jinyu Bio-technology Co Ltd |
CMAB806 |
IL-6R |
|
|
Hoffmann-La Roche |
Tocilizumab |
IL-6R |
|
|
Kodiak Sciences Inc. |
KSI-501 |
IL-6/VEGF |
|
|
Tiziana Life Sciences/NovImmune |
TZLS-501, NI-1201 |
IL-6R |
|
|
Regeneron, Assistance Publique – Hôpitaux de Paris |
Sarilumab |
IL-6R |
|
|
IcanoMAB |
|
IL-1R7 |
|
|
Bristol-Myers Squibb |
BMS-986253, HuMax-IL8, HuMax-Inflam/MDX018 |
IL-8 |
|
|
Novartis Pharmaceuticals |
Canakinumab |
IL-1 beta |
|
|
Pesquisador/Novartis Biociencia S.A. ; Lomonosov Moscow State University Medical Research and Educational Center |
Secukinumab |
IL-17a |
|
|
Xiangya Hospital of Central South University |
Ixekizumab |
IL-17A |
|
|
NIH |
Risankizumab |
IL-23 p19 |
|
|
Genentech |
Astegolimabt |
IL-33R |
|
|
Izana Bioscience |
Namilumab |
GM-CSF |
|
|
Omeros Corporation |
Narsoplimab |
MASP-2 |
|
|
Biocon |
Itolizumab |
CD6 |
|
|
CytoDyn |
Leronlimab |
CCR5 |
|
|
Adrenomed AG |
Adrecizumab |
Adrenomedulin |
|
|
Argenx |
|
C2 |
|
|
Akesobio Australia Pty Ltd |
|
CD73 |
|
|
Tiziana Life Sciences plc |
Foralumab |
CD3 epsilon |
|
|
Takeda, Shire/Radboud University |
Lanadelumab-flyo, lanadelumab |
Plasma kallikrein |
|
|
Eli Lilly |
Zansecimab |
Ang-2 |
|
|
Hudson Medical, Alexion, Assistance Publique – Hôpitaux de Paris |
Eculizumab |
C5 |
|
|
Innate Pharma SA |
Avdoralimab |
C5aR |
|
|
CSL Behring |
Garadacimab |
Factor XIIa |
|
|
Roivant Sciences |
Gimsilumab |
GM-CSF |
|
|
GlaxoSmithKline |
Otilimab |
GM-CSF |
|
|
Eli Lilly |
Zansecimab |
Ang-2 |
|
|
Innate Pharma SA |
Monalizumab |
NKG2A (aka CD159a) |
|
|
Medica Scientia Innovation Research (MEDSIR) |
Pembrolizumab |
PD-1 |
|
|
Novartis Pharmaceuticals |
Sabatolimab |
TIM-3 |
|
|
Celltrion, Tufts Medical Center |
Infliximab |
TNF |
|
|
Implicit Bioscience |
Atibuclimab |
CD14 |
|
|
Acticor Biotech |
Glenzocimab |
Glycoprotein VI platelet |
|
|
InflaRx/Beijing Defengrei Biotechnology Co. Ltd. |
Vilobelimab |
C5a |
|
|
FibroGen, Inc. |
Pamrevlumab |
Connective tissue growth factor (aka CCN2) |
|
|
I-Mab Biopharma |
Plonmarlimab |
GM-CSF |
|
|
Edesa Biotech, Light Chain Bioscience |
|
Toll-like receptor 4 |
|
|
Qilu Hospital of Shandong University, Renmin Hospital of Wuhan University, Ialy Moriggia Pelascini Gravedona Hospital S.p.A Wuhan University, Jiangbei Union Hospital of Huazhong University of science and technology, Shandong Provincial Chest Hospital |
Bevacizumab |
VEGF |
|
|
Alexion Pharmaceuticals |
Ravulizumab-cwvz |
C5 |
|
|
Humanigen, Inc. |
Lenzilumab |
GM-CSF |
|
|
ZyVersa Therapeutics, Inc. |
|
ASC |
|
|
Edesa Biotech, Light Chain Bioscience |
|
CXCL10 |
|
|
Aqualung Therapeutics / Fusion Antibodies |
Enamptcumab |
Nicotinamide phosphoribosyltransferase (NAMPT) |
|
|
Syndax Pharmaceuticals, Inc |
Axatilimab |
CSF1R/CD115 |
|
|
Swedish Orphan Biovitrum |
Emapalumab |
IFN gamma |
|
|
CSL Limited |
|
G-CSF (aka CSF 3) |
Conclusion
Enfin, si l’on peut risquer des pronostics sans boule de cristal dans cette maladie, on peut espérer que ces anticorps monoclonaux rendront des services dans cette population particulière d’immunodéprimés jusqu’à ce qu’une prophylaxie médicamenteuse généralisée puisse être mise en place à partir d’un médicament spécifique de telle ou telle enzyme du virus. Plusieurs produits en développement font espérer cela pour le milieu de l’année 2022.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de lien d’intérêt en rapport avec cet article.
Références
1. Von Behring E, Kitasato S. Ueber das Zustandekommen der Diphtherie-Immunitat and der Tetanus-Immunität bei Thieren. Dtsch Med Wochenschr 1890 ; 16 : 1113-4.
2. Kaufmann SHE. Remembering Emil von Behring: from Tetanus Treatment to Antibody Cooperation with Phagocytes. mBio 2017 ; 8 :e00117-17.
3. Demont M, Carnoy C. Il y a un siècle, l’âge d’or de la sérothérapie. Revue de Biologie Médicale 2016 ; 328: 59-67. https://www.revuebiologiemedicale.fr/biologie-et-histoire/biologie-et-histoire-archives/331-renato-dulbecco-de-la-virologie-a-la-cancerologie-5.html.
4. Kaufmann SHE. Immunology’s foundation: the 100-year anniversary of the Nobel Prize to Paul Ehrlich and Elie Metchnikoff. Nat Immunol2008 ; 9 :705-12.
5. Jahrling PB, Geisbert JB, Swearengen JR, Larsen T, Geisbert TW. Ebola hemorrhagic fever: evaluation of passive immunotherapy in nonhuman primates. J Infect Dis 2007 ; 196 Suppl 2 :S400-3.
6. CORIMUNO-CORIPLASM : évaluation de l’efficacité et de la tolérance du plasma de convalescents dans la Covid-19 de forme modérée, essai national multicentrique. Sorbonne Université. https://sante.sorbonne-universite.fr/recherche-0/appel-projets/aap-covid19-sorbonne-universite-faculte-de-medecine/corimuno-coriplasm.
7. da Costa CBP, Martins FJ, da Cunha LER, Ratcliffe NA, Cisne de Paula R, Castro HC. Covid-19 and Hyperimmune sera: A feasible plan B to fight against coronavirus. Int Immunopharmacol 2021 ; 90 : 107220.
8. Clinical Trial on Coronavirus Disease 2019 (Covid-19): Covid-19 convalescent plasma – Clinical Trials Registry – ICH GCP. https://clinicaltrials.gov/ct2/show/NCT04497779.
9. Korley FK, Durkalski-Mauldin V, Yeatts SD, Schulman K, Davenport RD, Dumont LJ, et al. Early Convalescent Plasma for High-Risk Outpatients with Covid-19. N Engl J Med 2021 ; 18 : oa2103784.
10. Wu F, Yan R, Liu M, Liu Z, Wang Y, Luan D, et al. Antibody-dependent enhancement (ADE) of SARS-CoV-2 infection in recovered Covid-19 patients: studies based on cellular and structural biology analysis. medRxiv 2020 ; 2020.10.08.20209114. doi: https://doi.org/10.1101/2020.10.08.20209114.
11. Yahi N, Chahinian H, Fantini J. Infection-enhancing anti-SARS-CoV-2 antibodies recognize both the original Wuhan/D614G strain and Delta variants. A potential risk for mass vaccination. J Infect 2021 ; 9 : 10.1016/j.jinf.2021.08.010.
12. Regis Peffault de Latour, Anne Bergeron, Etienne Lengline, Thibault Dupont, Armance Marchal, Lionel Galicier, et al. Complement C5 inhibition in patients with Covid-19 – a promising target? Haematologica 2020 ; 105 : 2847-50.
13. Risitano AM, Mastellos DC, Huber-Lang M, Yancopoulou D, Garlanda C, Ciceri F, Lambris JD. Complement as a target in Covid-19? Nat Rev Immunol 2020 ; 20 : 343-4.
14. Carvelli J, Demaria O, Vély F, Batista L, Chouaki Benmansour N, Fares J, et al. Association of Covid-19 inflammation with activation of the C5a–C5aR1 axis. Nature 2020 ; 588 : 146-50.
15. Gupta S, Leaf DE. Tocilizumab in Covid-19: some clarity amid controversy. Lancet 2021 ; 397 :1599-601.
16. Yang C, Zhao H. Tocilizumab in Covid-19 therapy: who benefits, and how? Lancet 2021 ; 398 :299.
17. Yun O. Tocilizumab, second drug ever recommended by WHO for Covid-19, will remain unaffordable and inaccessible for most of the world. ReliefWeb 2021. https://reliefweb.int/report/world/tocilizumab-second-drug-ever-recommended-who-covid-19-will-remain-unaffordable-and
18. Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975 ; 256 :495-7.
19. A therapeutic neutralizing antibody targeting receptor binding domain of SARS-CoV-2 spike protein. Nat Commun 2021 ; 12 : 288.
20. Pinto D, Park Y-J, Beltramello M, Walls AC, Tortorici MA, Bianchi S, et al. Cross-neutralization of SARS-CoV-2 by a human monoclonal SARS-CoV antibody. Nature 2020 ; 583 : 290-5.
21. Traggiai E, Becker S, Subbarao K, Kolesnikova L, Uematsu Y, Gismondo MR, Murphy BR, Rappuoli R, Lanzavecchia A. An efficient method to make human monoclonal antibodies from memory B cells: potent neutralization of SARS coronavirus. Nat Med 2004 ; 10 : 871-5.
22. Otsmane B, Dosset G, Lebeau JP, Watier H. Anti-Sars-CoV-2 monoclonal antibodies and the essential role of general practitioners in this new therapeutic approach. Exercer-La Revue Francophone De Medecine Generale 2021 ; 172 : 166-72.
23. Niu L, Wittrock KN, Clabaugh GC, Srivastava V, Cho MW. A Structural Landscape of Neutralizing Antibodies Against SARS-CoV-2 Receptor Binding Domain. Front Immunol 2021 ; 12 :647934.
24. Structural basis for neutralization of SARS-CoV-2 and SARS-CoV by a potent therapeutic antibody. Science 2020 ; 369 : 1505-9.
25. Abraham J. Passive antibody therapy in Covid-19. Nat Rev Immunol 2020 ; 20 : 401-3.
26. Baum A, Fulton BO, Wloga E, Copin R, Pascal KE, Russo V, et al. Antibody cocktail to SARS-CoV-2 spike protein prevents rapid mutational escape seen with individual antibodies. Science 2020 ; 369 : 1014-8.
27. Gottlieb RL, Nirula A, Chen P, Boscia J, Heller B, Morris J, et al. Effect of Bamlanivimab as Monotherapy or in Combination With Etesevimab on Viral Load in Patients With Mild to Moderate Covid-19: A Randomized Clinical Trial. JAMA 2021 ; 325 : 632.
28. Dong J, Zost SJ, Greaney AJ, Starr TN, Dingens AS, Chen EC, et al. Genetic and structural basis for SARS-CoV-2 variant neutralization by a two-antibody cocktail. Nat Microbiol 2021 ; 6 : 1233-44.
29. Gupta A, Gonzalez-Rojas Y, Juarez E, Crespo Casal M, Moya J, Falci DR, et al. Early Treatment for Covid-19 with SARS-CoV-2 Neutralizing Antibody Sotrovimab. N Engl J Med 2021 : 10.1056/NEJMoa2107934.
30. de Alwis R, Chen S, Gan ES, Ooi EE. Impact of immune enhancement on Covid-19 polyclonal hyperimmune globulin therapy and vaccine development. EBioMedicine 2020 ; 55 : 102768.
31. Karthik K, Senthilkumar TMA, Udhayavel S, Raj GD. Role of antibody-dependent enhancement (ADE) in the virulence of SARS-CoV-2 and its mitigation strategies for the development of vaccines and immunotherapies to counter Covid-19. Hum Vaccin Immunother 2020 ; 16 : 3055-60.
32. Andreano E, Piccini G, Licastro D, Casalino L, Johnson NV, Paciello I, et al. SARS-CoV-2 escape from a highly neutralizing Covid-19 convalescent plasma. Proc Natl Acad Sci 2021 ; 118 : e2103154118.
33. Felten R, Duret P-M, Bauer E, Sedmak N, Djossou JH, Bensalem M, et al. B-cell targeted therapy is associated with severe Covid-19 among patients with inflammatory arthritides: a 1-year multicentre study in 1116 successive patients receiving intravenous biologics. Ann Rheum Dis 2021 ; annrheumdis-2021-220549.
34. O’Brien MP, Forleo-Neto E, Musser BJ, Flonza I, et al. Subcutaneous REGEN-COV Antibody Combination to Prevent Covid-19. N EnglJ Med 2021 ; 385 :1184-95.
35. Nathan R, Shawa I, De La Torre I, Pustizzi JM, Haustrup N, Patel DR, Huhn G. A Narrative Review of the Clinical Practicalities of Bamlanivimab and Etesevimab Antibody Therapies for SARS-CoV-2. Infect Dis Ther 2021 ; 10 : 1933-47.
36. Dougan M, Nirula A, Azizad M, Mocherla B, Gottlieb RL, Chen P, et al. Bamlanivimab plus Etesevimab in Mild or Moderate Covid-19. N Engl J Med 2021 ; 385 : 1382-92.
37. Commissioner, O. of the. Coronavirus (Covid-19) Update: FDA Authorizes Additional Monoclonal Antibody for Treatment of Covid-19. FDA https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-additional-monoclonal-antibody-treatment-covid-19 (2021).
38. EUA Info For HCPs. Sotrovimab Clinical, Safety, & Variant Information. https://www.sotrovimab.com/hcp/clinical-safety-variant-info/.
39. Celltrion use of regdanvimab for the treatment of Covid-19. Committee for Medicinal Products for Human Use (CHMP). EMEA/H/A-5(3)/1505 2021.
40. A Study to Evaluate the Efficacy and Safety of Sirukumab in Confirmed Severe or Critical Confirmed Coronavirus Disease (Covid)-19. Clinical Research Trial Listing (Critical Confirmed Coronavirus Disease (Covid)-19. Severe or Critical Confirmed Coronavirus Disease (Covid)-19 ) (NCT04380961). https://www.centerwatch.com/clinical-trials/listings/243797/a-study-to-evaluate-the-efficacy-and-safety-of-sirukumab-in-confirmed-severe-or-critical-confirmed-coronavirus-disease-covid-19/.
41. The Methodist Hospital Research Institute. Clazakizumab vs. Placebo - COVID-19 Infection. A Phase 2 Trial to Evaluate the Safety and Tolerability of Clazakizumab® [Anti-Interleukin (IL)-6 Monoclonal] Compared to Placebo for the Treatment of Covid-19 Infection. 2020. https://clinicaltrials.gov/ct2/show/NCT04494724.
42. Pharma, C. Cromos Pharma Supports R-Pharm in Initiation of a Global Program to Test Two of its Leading Candidates in Patients with Severe Covid-19 Infection. First Patients Have Been Recruited. GlobeNewswire News Room 2020. https://www.globenewswire.com/news-release/2020/04/28/2022958/0/en/Cromos-Pharma-Supports-R-Pharm-in-Initiation-of-a-Global-Program-to-Test-Two-of-its-Leading-Candidates-in-Patients-with-Severe-Covid-19-Infection-First-Patients-Have-Been-Recruited.html.
43. Antonov VN, Ignatova GL, Pribytkova OV, Sleptsova SS, Strebkova EA, Khudyakova EA, et al. Experience of olokizumab use in Covid-19 patients. Ter Arkh 2020 ; 92 :148-54.
44. Gritti, G. An Observational Study of the Use of Siltuximab (SYLVANT) in Patients Diagnosed With Covid-19 Infection Who Have Developed Serious Respiratory Complications (SISCO). 2020.https://clinicaltrials.gov/ct2/show/NCT04322188.
45. McKee, S. Positive early data from siltuximab Covid-19 trial. PharmaTimes 2020. http://www.pharmatimes.com/news/positive_early_data_from_siltuximab_covid-19_trial_1334145.
46. Coomes EA, Haghbayan H. Interleukin-6 in Covid-19: A systematic review and meta-analysis. Rev Med Virol 2020 ; 30 : 1-9.
47. Xu X, Han M, Li T, Sun W, Wang D, Fu B, et al. Effective treatment of severe Covid-19 patients with tocilizumab. Proc Natl Acad Sci 2020 ; 117 : 10970-5.
48. Luo P, Liu Y, Qiu L, Liu X, Liu D, Li J. Tocilizumab treatment in Covid-19: A single center experience. J Med Virol 2020 ; 92 : 814-8.
49. Michot J-M, Albiges L, Chaput N, Saada V, Pommeret F, Griscelli F, et al. Tocilizumab, an anti-IL-6 receptor antibody, to treat COVID-19-related respiratory failure: a case report. Ann Oncol 2020 ; 31 : 961-4.
50. Kodiak Sciences Announces First Quarter 2020 Financial Results and Recent Business Highlights. Kodiak Sciences https://kodiak.com/press-releases/kodiak-sciences-announces-first-quarter-2020-financial-results-and-recent-business-highlights/.
51. Tiziana Life Sciences. http://www.tizianalifesciences.com/drug-pipeline/anti-il-6r/. doi: https://doi.org/10.1101/2021.06.02.21258204
52. Raimondo MG, Biggioggero M, Crotti C, Becciolini A, Favalli EG. Profile of sarilumab and its potential in the treatment of rheumatoid arthritis. Drug Des Devel Ther 2017 ; 11 : 1593-603.
53. Regeneron Pharmaceuticals. An Adaptive Phase 2/3, Randomized, Double-Blind, Placebo-Controlled Study Assessing Efficacy and Safety of Sarilumab for Hospitalized Patients With Covid-19. 2021. clinicaltrials.gov.
54. Assistance Publique-Hôpitaux de Paris. Cohort Multiple Randomized Controlled Trials Open-label of Immune Modulatory Drugs and Other Treatments in Covid-19 Patients – Sarilumab Trial – CORIMUNO-19 – SARI. 2020. clinicaltrials.gov.
55. Henriksen M. Effectiveness of Interleukin-6 Receptor Inhibitors in the Management of Patients With Severe SARS-CoV-2 Pneumonia: An Open-Label, Multicenter Sequential and Cluster Randomized Trial. 2020. clinicaltrials.gov.
56. Sanofi. An Adaptive Phase 3, Randomized, Double-blind, Placebo-controlled Study Assessing Efficacy and Safety of Sarilumab for Hospitalized Patients With Covid19. clinicaltrials.gov; 2021.
57. IcanoMAB. https://icanomab.com/.
58. Dallos M. A Randomized Phase 2 Study of Anti-IL-8 Therapy Versus Standard of Care in the Treatment of Hospitalized Patients With Severe Covid-19. clinicaltrials.gov; 2020.
59. Katia F, Myriam DP, Ucciferri C, Auricchio A, Di Nicola M, Marchioni M, et al. Efficacy of canakinumab in mild or severe Covid‐19 pneumonia. Immun Inflamm Dis 2021 ; 9 : 399-405.
60. Caricchio R, Abbate A, Gordeev I, Meng J, Hsue PY, Neogi T, et al. Effect of Canakinumab vs Placebo on Survival Without Invasive Mechanical Ventilation in Patients Hospitalized With Severe Covid-19: A Randomized Clinical Trial. JAMA 2021 ; 326 : 230-9.
61. Hasan MJ, Rabbani R, Anam AM, Huq SMR. Secukinumab in severe Covid-19 pneumonia: Does it have a clinical impact? J Infection 2021 ; 83 :e11-3.
62. Ixekizumab Injection: MedlinePlus Drug Information. https://medlineplus.gov/druginfo/meds/a616025.html
63. Hansel K, Zangrilli A, Bianchi L, Peris K, Chiricozzi A, Offidani A, et al. A multicenter study on effectiveness and safety of risankizumab in psoriasis: an Italian 16‐week real‐life experience during the Covid‐19 pandemic. J Eur Acad Dermatol Venereol 2021 ; 35(3):e169-e170.
64. Genentech, Inc. A Phase II, Randomized, Double-Blind, Placebo-Controlled, Multicenter Study to Evaluate the Safety and Efficacy of MSTT1041A or UTTR1147A in Patients With Severe Covid-19 Pneumonia. 2021. clinicaltrials.gov.
65. Astegolimab Completed Phase 2 Trials for Covid-19 Pneumonia/Coronavirus Disease 2019 (Covid-19) Treatment | DrugBank Online.
66. Fisher BA, Veenith T, Slade D, Gaskell C, Rowland M, Whitehouse T, et al. Namilumab or infliximab compared to standard of care in hospitalised patients with Covid-19 (CATALYST): a phase 2 randomised adaptive trial. Intensive Care and Critical Care Medicine 2021. doi: https://doi.org/10.1101/2021.06.02.21258204
67. Rambadi A, Gritti G, Micò MC, Frigeni M, Borleri G, Salvi A, et al. Endothelial injury and thrombotic microangiopathy in Covid-19: Treatment with the lectin-pathway inhibitor narsoplimab. Immunobiology 2020 ; 225(6) : 152001.
68. Atal S, Fatima Z, Balakrishnan S. Approval of Itolizumab for Covid-19: A Premature Decision or Need of The Hour? BioDrugs 2020 ; 34 : 705-11.
69. Agresti N, Lalezari JP, Amodeo PP, Mody K, Mosher SF, Seethamraju H, et al. Disruption of CCR5 signaling to treat Covid-19-associated cytokine storm: Case series of four critically ill patients treated with leronlimab. J Transl Autoimmun 2021 ; 4 : 100083.
70. CytoDyn, Inc. A Phase 2b/3, Randomized, Double Blind, Placebo Controlled, Adaptive Design Study to Evaluate the Efficacy and Safety of Leronlimab for Patients With Severe or Critical Coronavirus Disease 2019 (Covid-19). clinicaltrials.gov, 2021.
71. Karakas M, Jarczak D, Becker M, Roedl K, Addo MM, Hein F, et al. Targeting Endothelial Dysfunction in Eight Extreme-Critically Ill Patients with Covid-19 Using the Anti-Adrenomedullin Antibody Adrecizumab (HAM8101). Biomolecules 2020 ; 10 : 1171.
72. Van de Walle I, Silence K, Budding K, Van de Ven L, Dijkxhoorn K, de Zeeuw E, et al. ARGX-117, a therapeutic complement inhibiting antibody targeting C2. J Allerg Clin Immunol 2021 ; 147 : 1420-1429.e7.
73. Miller RA, Guru P, Bauer P, Robles J, Tomaszewski C, Overcash JS, et al. Clinical Results with a B Cell Activating Anti-CD73 Antibody for the Immunotherapy of Covid-19. medRxiv 2021 : 2021.09.13.21263406. doi: https://doi.org/10.1101/2021.09.13.21263406.
74. Moreira TG, Matos KTF, De Paula GS, Santana TMM, Da Mata RG, Pansera FC, et al. Nasal Administration of Anti-CD3 Monoclonal Antibody (Foralumab) Reduces Lung Inflammation and Blood Inflammatory Biomarkers in Mild to Moderate Covid-19 Patients: A Pilot Study. Front Immunol 2021 ; 12 : 709861.
75. EUCTR2020-002472-12-NL. Lanadelumab for treatment of COVID-19 disease. http://www.who.int/trialsearch/Trial2.aspx?TrialID=EUCTR2020-002472-12-NL
76. Pre-made Zansecimab biosimilar (Whole mAb, anti-ANGPT2 therapeutic antibody)-benchmark reference antibody | GeneMedi.
77. Kumar D, Gauthami S, Bayry J, Kaveri SV, Hegde NR. Antibody Therapy: From Diphtheria to Cancer, Covid-19, and Beyond. Monoclon Antib Immunodiagn Immunother 2021 ; 40 : 36-49.
78. Diurno F, Numis FG, Porta G, Cirillo F, Maddaluno S, Ragozzino A, et al. Eculizumab treatment in patients with COVID-19: preliminary results from real life ASL Napoli 2 Nord experience. Eur Rev Med Pharmacol Sci 2020 ; 24 : 4040-7.
79. Deb P, Molla MMA, Saif-Ur-Rahman KM. An update to monoclonal antibody as therapeutic option against Covid-19. Biosaf Health 2021 ; 3 : 87-91.
80. CSL Behring. A Phase 2, Multicenter, Double Blind, Randomized, Placebo-Controlled Study to Evaluate CSL312 in Coronavirus Disease 2019 (Covid19). clinicaltrials.gov, 2021.
81. CSL Behring evaluates monoclonal antibody in Covid-19 patients. https://www.clinicaltrialsarena.com/news/csl-behring-covid-19-trial/.
82. Kinevant Sciences GmbH. A Multi-Center, Adaptive, Randomized, Double-blind, Placebo-controlled Study to Assess the Efficacy and Safety of Gimsilumab in Subjects With Lung Injury or Acute Respiratory Distress Syndrome Secondary to Covid-19 (BREATHE). clinicaltrials.gov ; 2021.
83. Philippidis A. Roivant Sciences - Gimsilumab. GEN - Genetic Engineering and Biotechnology News. 2020. https://www.genengnews.com/covid-19-candidates/roivant-sciences-gimsilumab/.
84. Gimsilumab trial starts in first US patient with ARDS and Covid-19. News-Medical.net. https://www.news-medical.net/news/20200416/Gimsilumab-trial-starts-in-first-US-patient-with-ARDS-and-Covid-19.aspx (2020).
85. Patel J, ChB M, Beishuizen A, Ruiz XB, Cahn A, Criner GJ, et al. A Randomized Trial of Otilimab in Severe COVID-19 Pneumonia (OSCAR). medRxiv 2021 ; 2021.04.14.21255475.
86. Martin-Liberal J, Hollebecque A, Aftimos P, Jungels C, Martin-Romano P, Rodon J, et al. First-in-human, dose-escalation, phase 1 study of anti-angiopoietin-2 LY3127804 as monotherapy and in combination with ramucirumab in patients with advanced solid tumours. Br J Cancer 2020 ; 123 : 1235-43.
87. KEGG DRUG: Zansecimab. https://www.kegg.jp/entry/D11904.
88. Yaqinuddin A, Kashir J. Innate immunity in Covid-19 patients mediated by NKG2A receptors, and potential treatment using Monalizumab, Cholroquine, and antiviral agents. Med Hypotheses 2020 ; 140 : 109777.
89. Antonioli L, Fornai M, Pellegrini C, Blandizzi C. NKG2A and Covid-19: another brick in the wall. Cell Mol Immunol 2020 ; 17 : 672-4.
90. Tocilizumab plus Pembrolizumab in Covid-19. 30 juin 2021. https://clinicaltrials.gov/ct2/show/NCT04335305.
91. Novartis receives FDA fast track designation for sabatolimab (MBG453) in myelodysplastic syndromes. Novartis. https://www.novartis.com/news/novartis-receives-fda-fast-track-designation-sabatolimab-mbg453-myelodysplastic-syndromes.
92. Abdullah A, Neurath MF, Atreya R. Mild Covid-19 Symptoms in an Infliximab-Treated Ulcerative Colitis Patient: Can Ongoing Anti-TNF Therapy Protect against the Viral Hyperinflammatory Response and Avoid Aggravated Outcomes? Visc Med 2020 ; 36 : 338-42.
93. Infliximab against severe Covid-19-induced cytokine storm syndrome with organ failure – a cautionary case series. Critical Care 2020 ; 24.
94. Patel S, Saxena B, Mehta P. Recent updates in the clinical trials of therapeutic monoclonal antibodies targeting cytokine storm for the management of Covid-19. Heliyon 2021 ; 7 : e06158.
95. Acticor Biotech. A Randomized, Double Blind, Multicenter, Placebo Controlled, Parallel Group, Exploratory Efficacy and Safety Study of Glenzocimab in SARS-Cov-2-related Acute Respiratory Distress Syndrome. 2021. clinicaltrials.gov.
96. Glenzocimab, a Novel Antiplatelet Therapy in Covid-19 Related Acute Respiratory Distress Syndrome (ARDS): The GARDEN Study, a Phase 2 Clinical Trial. ISTH Congress Abstracts 2021.
97. Vlaar APJ, de Bruin S, Busch M, Timmermans SAMEG, van Zeggeren IE, Koning R, et al. Anti-C5a antibody IFX-1 (vilobelimab) treatment versus best supportive care for patients with severe Covid-19 (PANAMO): an exploratory, open-label, phase 2 randomised controlled trial. Lancet Rheumatol 2020 ; 2 : e764-73.
98. InflaRx Completes Enrollment of Vilobelimab Phase III Study in Severe Covid-19. BioSpace 2021. https://www.biospace.com/article/inflarx-completes-enrollment-of-vilobelimab-phase-iii-study-in-severe-covid-19/.
99. Definition of pamrevlumab – NCI Drug Dictionary – National Cancer Institute. https://www.cancer.gov/publications/dictionaries/cancer-drug/def/pamrevlumab (2011).
100. Clinical Trial on Covid-19: Pamrevlumab, Placebo – Clinical Trials Registry – ICH GCP. https://ichgcp.net/clinical-trials-registry/NCT04432298.
101. Race to a Cure for Covid-19. https://racetoacure.stanford.edu/development-leads/217.
102. I-Mab’s Positive Interim Results of its Plonmarlimab for severe Covid-19. https://imapac.com/news-page/this-weeks-biologics-news-roundup-i-mab-positive-results-plonmarlimab-covid-19/.
103. I-Mab thinks cytokine storm drug can take on Humanigen’s lenzilumab in sickest Covi-19 patients. FierceBiotech https://www.fiercebiotech.com/biotech/i-mab-thinks-cytokine-storm-drug-can-take-humanigen-s-lenzilumab-sickest-covid-19-patients.
104. Edesa Biotech, Inc. (Nasdaq: EDSA) – Clinical Stage Treatments for Inflammatory and Immune Related Diseases.
105. Pang J, Xu F, Aondio G, Li Y, Fumagalli A, Lu M, et al. Efficacy and tolerability of bevacizumab in patients with severe Covid-19. Nature Commun 2021 ; 12.
106. McEneny-King AC, Monteleone JPR, Kazani SD, Ortiz SR. Pharmacokinetic and Pharmacodynamic Evaluation of Ravulizumab in Adults with Severe Coronavirus Disease 2019. Inf Dis Ther 2021 ; 10 : 1045-54.
107. Temesgen Z, Burger CD, Baker J, Polk C, Libertin C, Kelley C, et al. Lenzilumab efficacy and safety in newly hospitalized Covid-19 subjects: results from the live-air phase 3 randomized double-blind placebo-controlled trial. medRxiv 2021 ; :2021.05.01.21256470.
108. Moderna Vaccine Reports Robust Covid-19 Antibody Response in Children. Contagion Live. https://www.contagionlive.com/view/lenzilumab-for-covid-19-improves-survival-without-ventilation-in-phase-3-trial.
109. de Rivero Vaccari JC, Dietrich WD, Keane RW, de Rivero Vaccari JP. The Inflammasome in Times of Covid-19. Front Immunol 2020 ; 11 :583373.
110. Freeman TL, Swartz TH. Targeting the NLRP3 Inflammasome in Severe Covid-19. Front Immunol 2020 ; 11 : 1518.
111. Edesa Biotech, Inc. (Nasdaq: EDSA) – Clinical Stage Treatments for Inflammatory and Immune Related Diseases.
112. Twomey JD, Luo S, Dean AQ, Bozza WP, Nalli A, Zhang B. Covid-19 update: The race to therapeutic development. Drug Resist Updat 2020 ; 53 : 100733.
113. Clinical Trial on Coronavirus: SNDX-6352, Placebo – Clinical Trials Registry – ICH GCP.
114. A Phase 2 Study to Evaluate Axatilimab for Hospitalized Patients With Respiratory Involvement Secondary to Covid-19. https://clinicaltrials.gov/ct2/show/NCT04415073.
115. NCT04324021. Efficacy and Safety of Emapalumab and Anakinra in Reducing Hyperinflammation and Respiratory Distress in Patients With Covid-19 Infection. https://clinicaltrials.gov/show/NCT04324021.
116. Kumar D, Gauthami S, Bayry J, Kaveri SV, Hegde NR. Antibody Therapy: From Diphtheria to Cancer, Covid-19, and Beyond. Monoclon Antib Immunodiagn Immunother 2021 ; 40 : 36-49.
