15 avril 2020 - Prise en charge des maladies inflammatoires chroniques de l’intestin à l’heure de l’épidémie COVID-19
Correspondance : Aurélien Amiot
Hôpitaux Universités Henri Mondor, Département de gastroentérologie, 51 avenue du Maréchal De Lattre De Tassigny 94000 Créteil
⇐ Retour au dossier "Actualités COVID-19"
Introduction
À l’heure où nous écrivons ces lignes, plus de 1 700 000 personnes ont été infectées par le nouveau coronavirus SARS-CoV-2 et plus de 100 000 en sont décédés dans le monde [1, 2]. En France, plus de 200 000 individus sont atteints par une maladie inflammatoire chronique de l’intestin (MICI) que ce soit une maladie de Crohn ou une rectocolite hémorragique posant la question de l’impact du SARS-CoV-2 sur ces affections et sur d’éventuelles adaptations thérapeutiques dans le contexte actuel [3].
Risque d’infection par le nouveau coronavirus SARS-CoV-2 au cours des MICI
Il n’existe à l’heure actuelle peu de données indicatives quant au risque d’infection par le SARS-CoV-2 ou COVID-19 chez les patients atteints de MICI. Quelques cas isolés de COVID-19 ont été rapportés dans la littérature. Des études transversales menées dans des zones particulièrement touchées dès le début de la pandémie, que ce soit en Chine à Wuhan ou en Italie à Bergame, n’ont identifié aucun cas de COVID-19 dans leurs cohortes respectives de patients MICI [4, 5]. Ces premières données sont donc rassurantes. Les résultats d’un observatoire rétrospectif international conduit sous l’égide de l’IOIBD (International Organisation for the study of Inflammatory Bowel Disease) et des sociétés internationales impliquées dans les MICI (https://covidibd.org/) qui a colligé plusieurs centaines de cas sont attendus très rapidement pour préciser ces premières informations [6].
Des études transversales menées dans des zones particulièrement touchées (Chine, Italie), n’ont identifié aucun cas de COVID-19 dans leurs cohortes respectives de patients MICI
En pratique, comme cela est recommandé par le GETAID et la SNFGE, il ne faut pas interrompre les traitements immunosuppresseurs et/ou biothérapies au cours des MICI dans un but préventif, car cette démarche mettrait les malades en danger d’une reprise évolutive de leur maladie inflammatoire chronique intestinale avec une perte de chance, ajoutant de manière certaine un problème supplémentaire à la crise sanitaire actuelle. Chez les patients infectés par le SARS-CoV-2, il semble raisonnable de suspendre les traitements immunomodulateurs le temps de la résolution de l’infection comme pour toute autre infection systémique potentiellement grave. Il convient enfin de discuter au cas par cas de l’interruption d’un traitement immunomodulateur chez les patients ayant un contage identifié ou une forme asymptomatique de COVID-19.
Il ne faut pas interrompre les traitements immunosuppresseurs et/ou biothérapies au cours des MICI dans un but préventif
Chez les patients infectés par le SARS-CoV-2, il semble raisonnable desuspendre les traitements immunomodulateurs le temps de la résolution de l’infection
Risque d’infection spécifique en fonction des traitements en cours
Concernant l’impact potentiel des traitements utilisés au cours des MICI sur l’infection virale, une altération de la réponse immunitaire innée à la phase précoce de l’infection par le SARS-CoV-2 pourrait favoriser la réplication du virus. À l’inverse, un excès de production de cytokines pro-inflammatoires comme l’interleukine-6 pourrait favoriser la survenue d’un syndrome de détresse respiratoire aiguë observé dans un second temps de l’infection.
Les experts internationaux ont émis des conseils pour l’utilisation de chaque molécule dans le contexte pandémique actuel récemment parus dans Gastroenterology. Ils sont synthétisés dans la figure 1. Les dérivés amino-salicylés peuvent être utilisés sans restriction compte tenu de leur mode d’action essentiellement topique.
Figure 1. Avis des experts de l'International Organisation of Inflammatory Bowel Disease (IOIBD) sur l'impact des traitements des MICI dans le contexte de la pandémie à SARS-Cov2 [14].
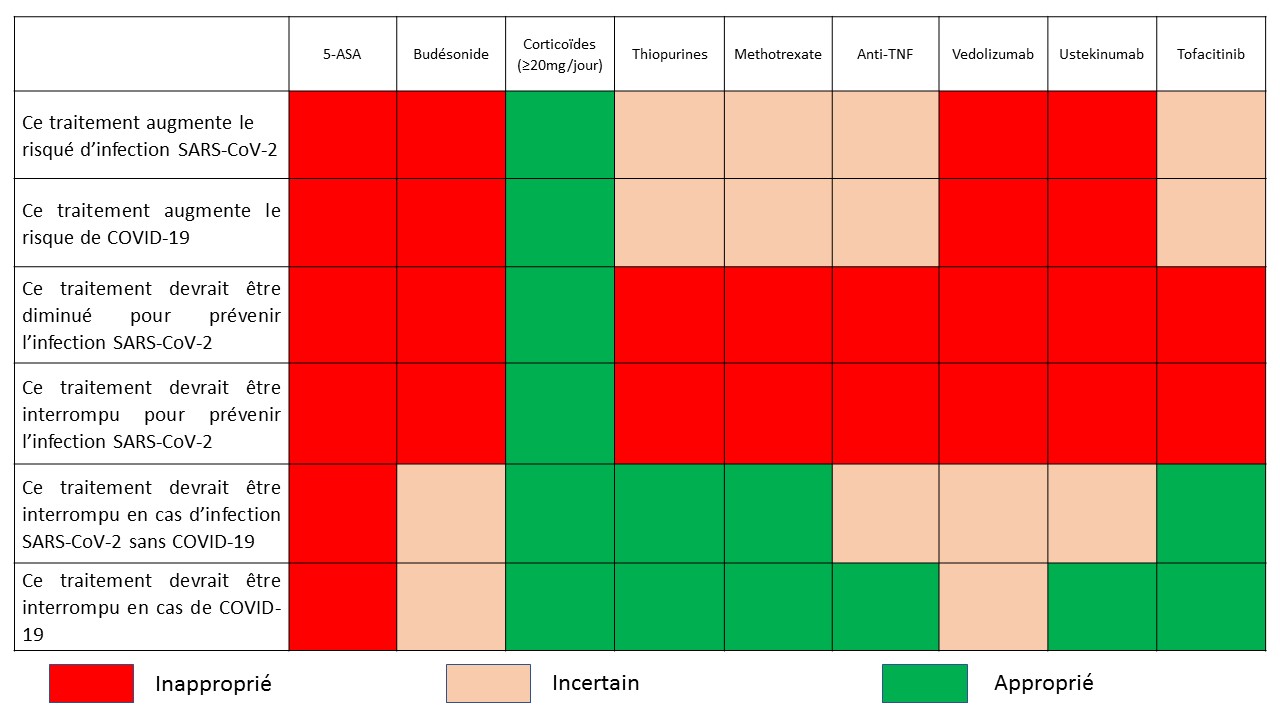
Concernant les corticoïdes systémiques, ils n’ont montré aucune efficacité dans le traitement de l’infection par le SARS-CoV et le MERS-CoV et entraînent un ralentissement de la clairance virale [7]. De plus, leur rôle délétère concernant le risque infectieux et la mortalité d’une façon générale ne plaide pas en faveur de leur utilisation dans ce contexte ; l’utilisation du budésonide est à privilégier dans cette situation [8-10].
Les thiopurines et le tofacitinib sont associés à une augmentation globale du risque d’infection virale et pourraient avoir un effet délétère en cas d’infection par le SARS-CoV-2 [11].
Les anti-TNF pourraient avoir un effet délétère sur le contrôle de la réplication virale mais un effet bénéfice sur la prévention de forme sévère de COVID-19 [12, 13]. Le vedolizumab de par sa sélectivité pour le tube digestif et l’ustekinumab plus sélectif que les anti-TNF ne semblent pas avoir d’impact potentiel sur l’infection SARS-CoV-2 [14].
En pratique, en cas de MICI active, le traitement de la poussée ne saurait être différé dans le contexte actuel d’infection par le SARS-CoV-2. Il conviendra alors de discuter au cas par cas de l’initiation d’un traitement immunosuppresseur et/ou d’une biothérapie. Il faudra alors prendre en compte, d’une part, le bénéfice attendu par le traitement et le risque encouru en l’absence de traitement, et, d’autre part, le risque spécifique de chaque molécule par rapport à celui de développer une forme sévère de COVID-19 selon l’âge et l’existence de comorbidités (diabète, hypertension artérielle, obésité, diabète ; maladies cardiaques ou respiratoires chroniques, insuffisance rénale chronique terminale, cirrhose Child-Pugh B ou C).
Dans l’ensemble, la prudence doit être de mise dans cette situation. C’est d’ailleurs pour cette raison que le Haut Conseil de Santé Publique a estimé que les patients traités par corticothérapie à dose immunosuppressive (≥ 20 mg/jour), par immunosuppresseur et/ou par biothérapie sans distinction, devaient être considérés comme étant à haut risque de développer une forme grave de COVID-19 et devait s’astreindre à une prévention maximale de l’infection (tableau 1) [15]. Enfin, concernant les interventions chirurgicales et les examens endoscopiques, il est recommandé de les reporter à distance sauf en cas d’indication urgente [16].
Il est recommandé de reporter à distance les interventions chirurgicales et les examens endoscopiques sauf en cas d’indication urgente
Tableau 1
Recommandations spécifiques pour les patients atteints de maladie inflammatoire chronique de l’intestin traités par corticothérapie systémique (≥ 20 mg/jour), immunosuppresseur et/ou biothérapie.
|
« Mesures barrières » ou mesures de distanciation sociale spécifiques aux personnes fragiles : |
|
– Contre-indiquer aux personnes à risque l’utilisation des moyens de transport collectifs pour privilégier les moyens de transports individuels. – Demander à ces personnes de limiter les déplacements individuels aux seuls déplacements essentiels. – Limiter les contacts avec les enfants âgés de moins de 10 ans. – Limiter les activités, professionnelles, sociales, cultuelles éducatives et associatives non essentielles. – Veiller à l’application de mesures barrières renforcées par l’entourage de ces personnes : lavage des mains toutes les heures, port d’un masque chirurgical dès le début de symptômes et éventuellement exclusion de personnes de l’entourage de personnes potentiellement malades. – Mettre en œuvre systématiquement pour ces personnes des moyens de communication alternatifs dans le cadre de leurs activités d’apprentissage ou professionnelles : e-learning, travail à distance, téléconférences… |
|
Mesures de prévention de l’infection à SARS-CoV-2 liées à la prise en charge des personnes à risque : |
|
– Communication aux patients par les équipes soignantes sur le risque d’infection par le SARS-CoV-2 – Établir un projet de soin spécifique de premier recours. – Adaptation de l’organisation des soins pour ces personnes fragiles au sein des établissements de santé. |
|
Mesures spécifiques relevant des hôpitaux de jour pour l’administration des biothérapies intraveineuses (infliximab et vedolizumab) pour prévenir un contage avec le SARS-CoV-2 : |
|
– Circuit patient spécifique de façon à éviter les files d’attente et les croisements avec des filières à risque d’infection par le SARS-CoV-2. – Contact téléphonique la veille pour dépister la présente de symptômes de COVID-19. – Vérification de l’absence de fièvre à l’arrivée en hôpital de jour. – Port de masque par le personnel soignant et les patients. – Réaménagement des locaux permettant de maintenir les mesures de distanciation sociale et l’occupation de chambre seule en évitant les salles communes. – Annulation de toute perfusion en cas de suspicion de COVID-19 et report de la perfusion à au moins 7 jours de la disparition des derniers symptômes. – Bionettoyage soigneux des locaux. |
Cas particulier des hôpitaux de jour pour les perfusions des biothérapies intraveineuses
Concernant les patients recevant de façon périodique une biothérapie par voie intraveineuse (infliximab et vedolizumab), il est essentiel de mettre en place une procédure spécifique en hôpital de jour. Les mesures barrières et les mesures de distanciation sociale doivent y être appliquées de façon stricte par les personnels soignants et par les patients. Le port de masque est recommandé pour tous les personnels soignants et tous les patients au sein de l’hôpital de jour. Une réorganisation du circuit doit également avoir lieu de façon à prévenir le risque de contage avec le SARS-CoV-2 (tableau 1).
Une réorganisation du circuit des hôpitaux de jour pour les perfusions des biothérapies intraveineuses doit être mise en plance afin de prévenir le risque de contage avec le SARS-CoV-2
À ce jour, il n’existe aucun élément faisant des patients atteints de MICI des sujets à risque de forme grave de COVID-19 et ce quel que soit leur traitement. Il est donc capital de les rassurer afin de poursuivre leur prise en charge et éviter des poussées inflammatoires qui constitueraient un dégât collatéral de plus de la pandémie en cours.
Liens d'intérêts
Les auteurs déclarent n’avoir aucun lien d’intérêt en rapport avec l’article.
Références
1. Anon. Coronavirus. Available at : https://www.who.int/emergencies/diseases/novel-coronavirus-2019 [Accessed April 10, 2020].
2. Guan W-J, Ni Z-Y, Hu Y, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020 Feb 28. doi: 10.1056/NEJMoa2002032. [Epub ahead of print] https://www.ncbi.nlm.nih.gov/pubmed/32109013
3. Kirchgesner J, Lemaitre M, Rudnichi A, et al. Therapeutic management of inflammatory bowel disease in real-life practice in the current era of anti-TNF agents : analysis of the French administrative health databases 2009-2014. Aliment Pharmacol Ther 2017 ; 45 : 37-49. https://www.ncbi.nlm.nih.gov/pubmed/27781286
4. Mao R, Liang J, Shen J, et al. Implications of COVID-19 for patients with pre-existing digestive diseases. Lancet Gastroenterol Hepatol 2020 ; 5 : 426-428. https://www.ncbi.nlm.nih.gov/pubmed/32171057
5. Norsa L, Indriolo A, Sansotta N, et al. Uneventful course in IBD patients during SARS-CoV-2 outbreak in northern Italy. Gastroenterology. 2020 Apr 2. pii: S0016-5085(20)30445-5. doi: 10.1053/j.gastro.2020.03.062. [Epub ahead of print] https://www.ncbi.nlm.nih.gov/pubmed/32247695
6. Mazza S, Sorce A, Peyvandi F, et al. A fatal case of COVID-19 pneumonia occurring in a patient with severe acute ulcerative colitis. Gut. 2020 Apr 3. pii: gutjnl-2020-321183. doi: 10.1136/gutjnl-2020-321183. [Epub ahead of print] https://www.ncbi.nlm.nih.gov/pubmed/32245909
7. Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. Lancet Lond Engl 2020 ; 395 : 473-475. https://www.ncbi.nlm.nih.gov/pubmed/32043983
8. Papi C, Luchetti R, Gili L, et al. Budesonide in the treatment of Crohn’s disease : a meta-analysis. Aliment Pharmacol Ther 2000 ; 14 : 1419-1428. https://www.ncbi.nlm.nih.gov/pubmed/11069312
9. Lewis JD, Scott FI, Brensinger CM, et al. Increased Mortality Rates With Prolonged Corticosteroid Therapy When Compared With Antitumor Necrosis Factor-α-Directed Therapy for Inflammatory Bowel Disease. Am J Gastroenterol 2018 ; 113 : 405-417. https://www.ncbi.nlm.nih.gov/pubmed/29336432
10. Lichtenstein GR, Feagan BG, Cohen RD, et al. Serious infections and mortality in association with therapies for Crohn’s disease : TREAT registry. Clin Gastroenterol Hepatol 2006 ; 4 : 621-630. https://www.ncbi.nlm.nih.gov/pubmed/16678077
11. Kirchgesner J, Lemaitre M, Carrat F, et al. Risk of serious and opportunistic infections associated with treatment of inflammatory bowel diseases. Gastroenterology 2018 ; 155 : 337-346. https://www.ncbi.nlm.nih.gov/pubmed/29655835
12. Li CK, Wu H, Yan H, et al. T cell responses to whole SARS coronavirus in humans. J Immunol Baltim Md 1950 2008 ; 181 : 5490-5500. https://www.ncbi.nlm.nih.gov/pubmed/18832706
13. Anon. A clinical study for the efficacy and safety of Adalimumab Injection in the treatment of patients with severe novel coronavirus pneumonia (COVID-19). Available at : http://www.chictr.org.cn/showprojen.aspx?proj=49889 [Accessed April 15, 2020].
14. Rubin DT, Abreu MT, Rai V, et al. Management of Patients with Crohn’s Disease and Ulcerative Colitis During the COVID-19 Pandemic : Results of an International Meeting. Gastroenterology 2020. Available at : https://linkinghub.elsevier.com/retrieve/pii/S0016508520304650 [Accessed April 10, 2020] .
15. Haut Comité de Santé Publique. Coronavirus : qui sont les personnes fragiles ? Ministère Solidar Santé 2020. Available at : http://solidarites-sante.gouv.fr/actualites/actualites-du-ministere/article/coronavirus-qui-sont-les-personnes-fragiles [Accessed April 13, 2020].
16. Anon. Epidémie de COVID-19 : recommandations en endoscopie digestive. SFED 2020. Available at : https://www.sfed.org/professionnels/actualites-pro/epidemie-de-covid-19-recommandations-en-endoscopie-digestive [Accessed April 15, 2020].
